MODELOS ATÓMICOS
Un modelo atómico es un diagrama conceptual o representación estructural de un átomo, cuyo fin es explicar sus propiedades y funcionamiento. Un modelo tiene el fin de asociar un concepto a un esquema o representación, en este caso del átomo, que es la más pequeña cantidad indivisible de materia. A lo largo de la historia existieron diversidad de modelos atómicos, el primero de los cuales fue postulado por el filósofo y matemático griego Demócrito.
*BIOGRAFIA: DEMOCRITO

*Demócrito (en griego: Abdera, Tracia, c. 460 a. C.-c. 370 a. C.) fue un filósofo y matemático griego que vivió entre los siglos V-IV a. C.
Tradicionalmente se le considera un filósofo presocrático, aunque es un error de cronología, ya que fue contemporáneo de Sócrates.
EL ATOMISMO
 Demócrito desarrolló la «teoría atómica del universo», concebida por su mentor, el filósofo Leucipo. Esta teoría, al igual que todas las teorías filosóficas griegas, no apoya sus postulados mediante experimentos, sino que se explica mediante razonamientos lógicos. La teoría atomista de Demócrito y Leucipo se puede esquematizar así:
Demócrito desarrolló la «teoría atómica del universo», concebida por su mentor, el filósofo Leucipo. Esta teoría, al igual que todas las teorías filosóficas griegas, no apoya sus postulados mediante experimentos, sino que se explica mediante razonamientos lógicos. La teoría atomista de Demócrito y Leucipo se puede esquematizar así:- Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
- Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
Democrito era eleata seguidor de la teoría de Parménides el consideraba que existia en la
naturaleza: Ser-Noser. Democrito piensa que el ser son los átomos y el noser es el vacio.
*BIOGRAFIA JHON DALTON
Nació el 6 de septiembre de 1766, en Eaglesfield, Cumberland (hoy Cumbria).
*BIOGRAFIA JHON DALTON
Nació el 6 de septiembre de 1766, en Eaglesfield, Cumberland (hoy Cumbria).
Químico y físico británico
- Reconocido por: Teoría atómica, Ley de proporciones múltiples, Ley de Dalton de presiones parciales, Daltonismo
- Áreas: Química, física y meteorología
TEORÍA ATÓMICA
Dalton postuló su teoría formulando una serie de enunciados simples:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa e iguales propiedades. Los átomos de diferentes elementos tienen masa diferente. Comparando la masa de los elementos con los del hidrógeno tomado como la unidad, propuso el concepto de peso atómico relativos
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos, guardan relaciones simples de números enteros y pequeños.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos.

La materia está formada por partículas muy pequeñas llamadas “átomos”. Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones. Por ejemplo: todos los átomos de hidrógeno son iguales.
*BIOGRAFIA JHOSEPT JHON THOMSON
EL MODELO ATÓMICO

*BIOGRAFIA ERNEST RUTHERFORD
 (Nelson, Nueva Zelanda, 1871 - Londres, 1937) Físico y químico británico.
(Nelson, Nueva Zelanda, 1871 - Londres, 1937) Físico y químico británico.MODELO ATÓMICO
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva.
El módelo atómico de Rutherford puede resumirse de la siguiente manera:
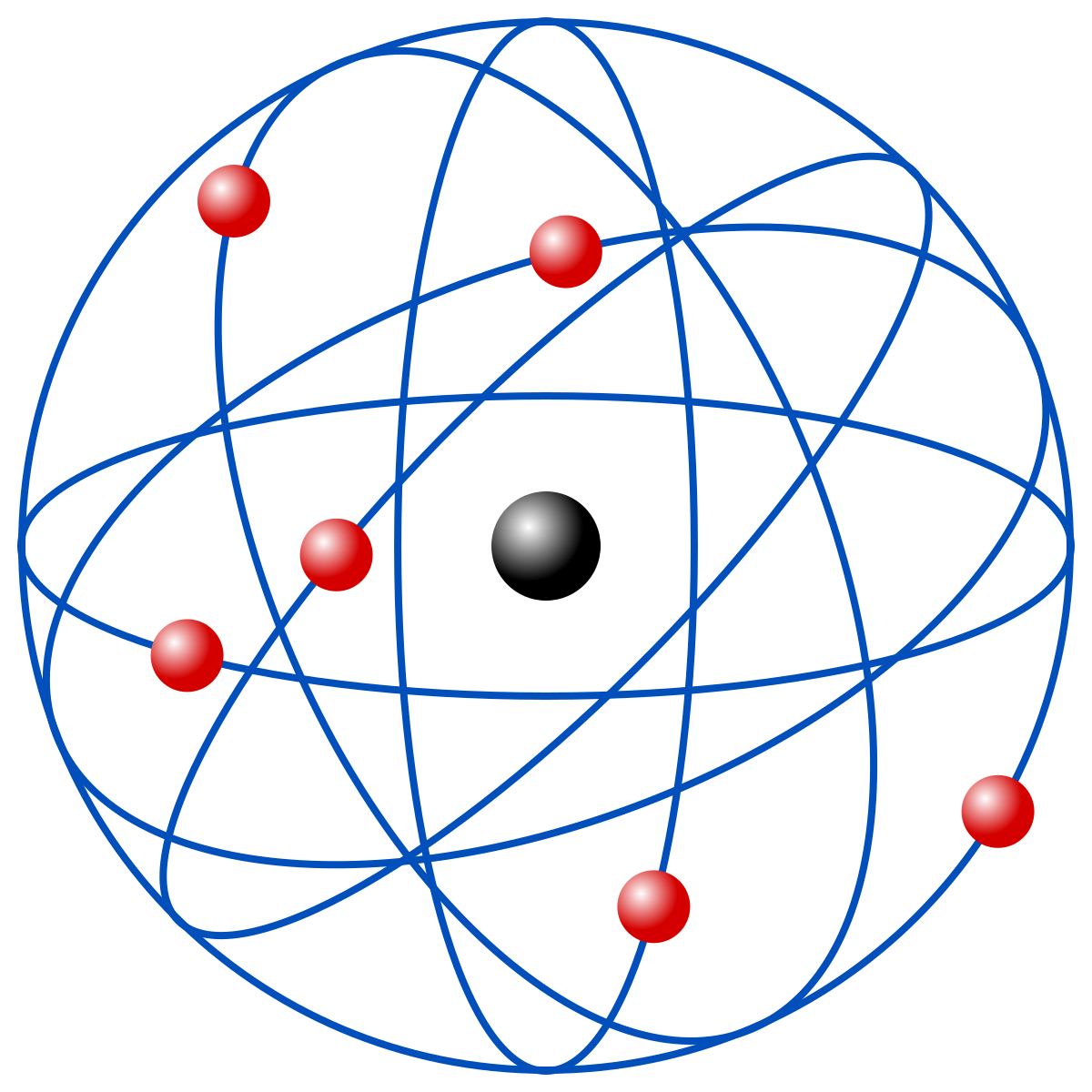 *El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo.
*El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo.
*Los electrones giran a grandes distancias alrededor del núcleo en órbitas circulares.
*La suma de las cargas eléctricas negativas de los electrones debe ser igual a la carga positiva del núcleo, ya que el átomo es eléctricamente neutro.

Niels Henrik David Bohr (Copenhague, 7 de octubre de 1885 - Valby, Copenhague, 18 de noviembre de 1962) fue un físicodanés que realizó contribuciones fundamentales para la comprensión de la estructura del átomo y la mecánica cuántica. Fue galardonado con el Premio Nobel de física en 1922.
INVESTIGACIONES CIENTÍFICAS

Basándose en las teorías de Ernest Rutherford (átomo de Rutherford) publicó su propio modelo atómico (modelo atómico de Bohr) en 1913, introduciendo la teoría de las órbitas cuantificadas, que en la teoría mecánica cuántica consiste en las características que, en torno al núcleo atómico, el número de electrones en cada órbita aumenta desde el interior hacia el exterior.
*BIOGRAFIA DE ARNOLD SOMMERFELD

Arnold Johannes Wilhelm Sommerfeld (5 de diciembre de 1868 - 6 de abril de 1951) fue un físico alemán que introdujo la constante de la estructura fina en 1919. Además de sus aportaciones como científico en los campos de la física atómica y de la física cuántica, es destacable su labor como docente, siendo director de tesis doctorales de numerosos futuros ganadores del premio Nobel tanto en física como en química
MODELO ATOMICO DE SOMMERFELD
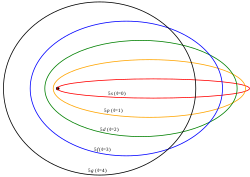
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de este. Para eso introdujo dos modificaciones básicas: Órbitas casi-elípticas para los electrones y velocidades relativistas. En el modelo de Bohr los electrones solo giraban en órbitas circulares. La excentricidad de la órbita dio lugar a un nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se lo representa con la letra l y toma valores que van desde 0 hasta n-1. Las órbitas son:
*BIOGRAFIA DE ERWIN SCHRODINGER

Basándose en las teorías de Ernest Rutherford (átomo de Rutherford) publicó su propio modelo atómico (modelo atómico de Bohr) en 1913, introduciendo la teoría de las órbitas cuantificadas, que en la teoría mecánica cuántica consiste en las características que, en torno al núcleo atómico, el número de electrones en cada órbita aumenta desde el interior hacia el exterior.
*BIOGRAFIA DE ARNOLD SOMMERFELD

Arnold Johannes Wilhelm Sommerfeld (5 de diciembre de 1868 - 6 de abril de 1951) fue un físico alemán que introdujo la constante de la estructura fina en 1919. Además de sus aportaciones como científico en los campos de la física atómica y de la física cuántica, es destacable su labor como docente, siendo director de tesis doctorales de numerosos futuros ganadores del premio Nobel tanto en física como en química
MODELO ATOMICO DE SOMMERFELD
- l = 0 se denominarían posteriormente orbitales s o sharp
- l = 1 se denominarían p o principal.
- l = 2 se denominarían d o diffuse.
- l = 3 se denominarían f o fundamental.
*BIOGRAFIA DE ERWIN SCHRODINGER
 Erwin Rudolf Josef Alexander Schrödinger (en alemán ; Erdberg, Viena, Imperio austrohúngaro, 12 de agosto de 1887 – id., 4 de enero de 1961) fue un físicoaustríaco, naturalizado irlandés, que realizó importantes contribuciones en los campos de la mecánica cuántica y la termodinámica. Recibió el Premio Nobel de Física en 1933 por haber desarrollado la ecuación de Schrödinger, compartido con Paul Dirac. Tras mantener una larga correspondencia con Albert Einstein propuso el experimento mental del gato de Schrödinger que mostraba las paradojas e interrogantes a los que abocaba la física cuántica.
Erwin Rudolf Josef Alexander Schrödinger (en alemán ; Erdberg, Viena, Imperio austrohúngaro, 12 de agosto de 1887 – id., 4 de enero de 1961) fue un físicoaustríaco, naturalizado irlandés, que realizó importantes contribuciones en los campos de la mecánica cuántica y la termodinámica. Recibió el Premio Nobel de Física en 1933 por haber desarrollado la ecuación de Schrödinger, compartido con Paul Dirac. Tras mantener una larga correspondencia con Albert Einstein propuso el experimento mental del gato de Schrödinger que mostraba las paradojas e interrogantes a los que abocaba la física cuántica.
MODELO ATÓMICO DE SCHODINGER
El modelo atómico de Schrodinger es un modelo cuántico no relativista.
En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico

- Eliminó el concepto de los electrones como esferas diminutas con cargas que giraban alrededor de órbitas
- Representa la probabilidad de la presencia del electrón en orbitales
.png)


No hay comentarios.:
Publicar un comentario